上 原子番号 質量数 書き方 947856-原子番号 質量数 書き方
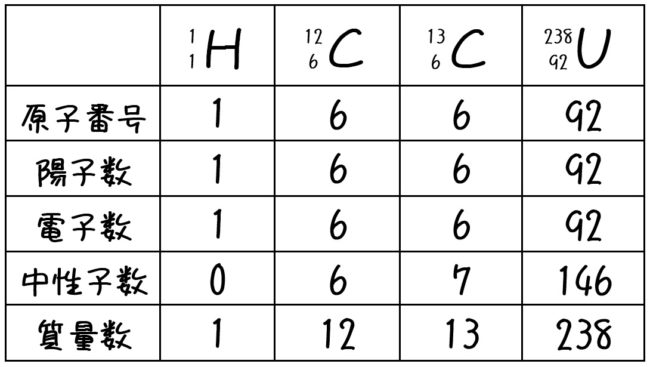
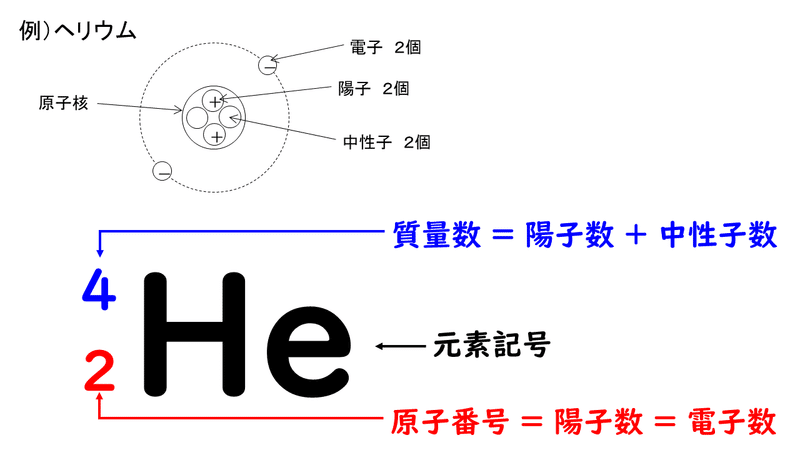
大人になって学ぶ 教養としての有機化学 Sur Twitter 原子番号と質量数 原子番号 原子がもつ陽子の数 質量数 原子がもつ陽子と中性子の 数を足したもの 原子番号n番の原子は一般に 陽子をn個 電子をn個 中性子をn個 くらい もっています 例 原子番号6番の炭素 C原子番号や質量数を付記する際の書き方 原子番号 や 質量数 を付記する場合、原子番号は左下に (13 Al)、質量数は左上に (27 Al) 、イオン価は右肩に (Al 3)、原子数は右下に (N 2) 付記する。 原子番号16番で 質量数35の基礎化学 INDEX へ戻る 原子 番号 元素 英語 記号 原子量 1 水素 Hydrogen H 1008 2 ヘリウム
Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 07 Pdf
原子番号 質量数 書き方
原子番号 質量数 書き方- 原子の重さを表す質量数は(極端に軽い電子は省くので)陽子の数と中性子の数を足した値となる。 原子の表記法 原子は元素記号という1〜2文字のアルファベットで表される。元素記号の 左上に質量数、左下に原子番号 を書く。 化学基礎 理論化学 原子の構造 原子・分子・元素の違いと陽子・中性子・質量数・原子番号 電子配置の書き方と一覧(周期表) 最外殻電子と価電子の定義と違い 同素体と同位体の違いと例(硫黄・炭素・酸素・リン) 単体・化合物・純物質・混合物の違いの見分け方と具体例 周期表の覚え方
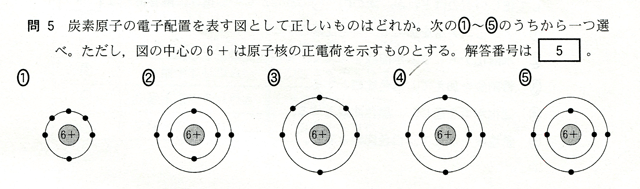



高認化学の過去問 21年第2回4 5 6
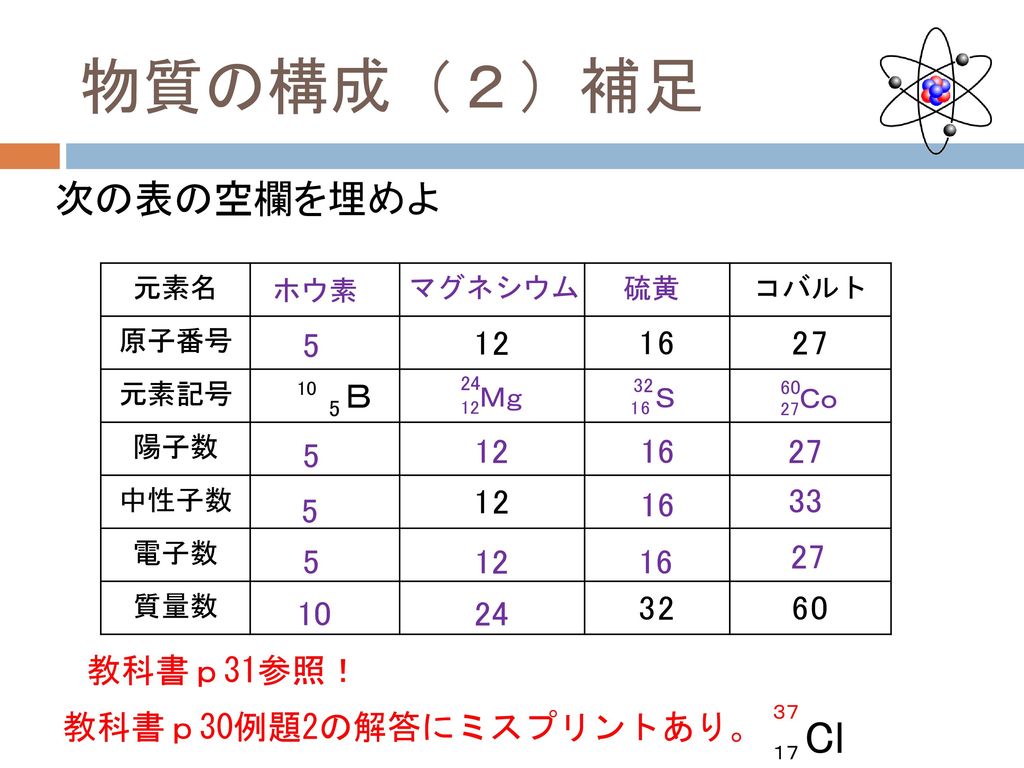
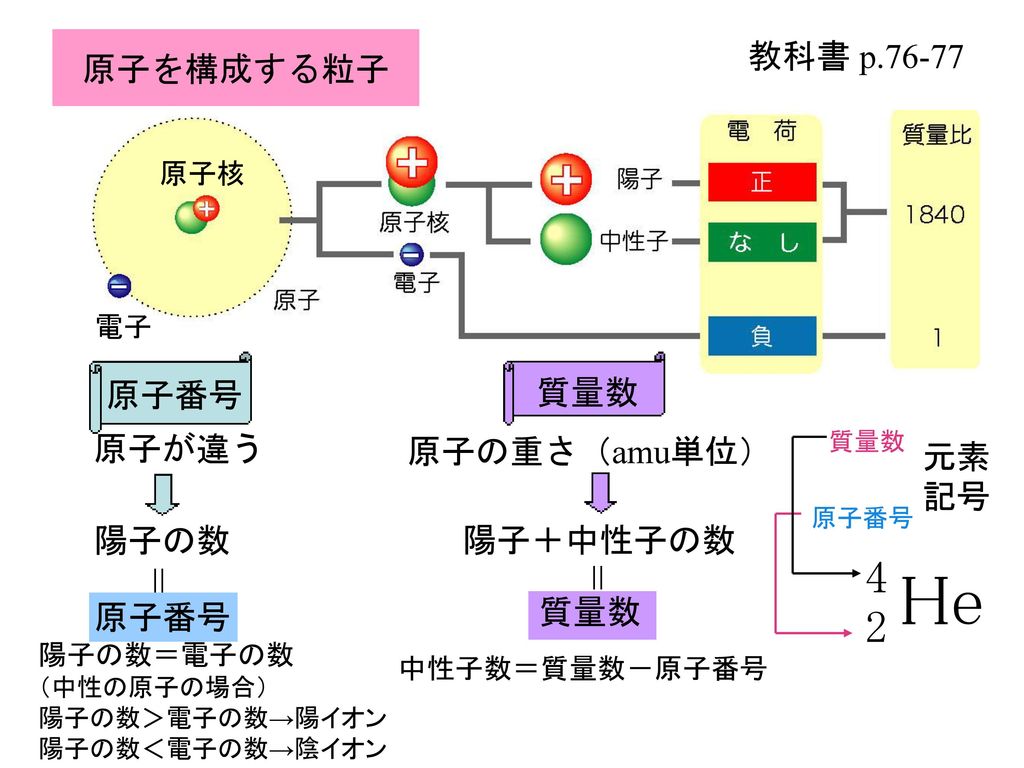
考えることができるので,体積は核子数,すな わち質量数にほぼ比例する。したがって原子核 の半径R(m)は次式で与えられる。 1R=r0 A /3 (1) ここでr0は12~14×10 -15 mである。原子と 原子核の大きさの違いは,水素ではざっと10 万倍,鉛でも約1万倍である。質量数195 の白金原子に何個の中性子がありますか? 解:白金の元素記号はPt、その原子番号(裏表紙参照)は78 です。よって原子は核に78 個の陽子を持ちます(核 の外側に配置される電子数は78)。原子の質量数は核の陽子と中性子の数の和です。 従って、・原子においては,「原子番号 = 陽子の数 = 電子の数」が成り立つ。 ・「質量数 = 陽子の数 中性子の数」の関係がある。 ・元素記号の左上に質量数,左下に原子番号を書く。 問1 問2
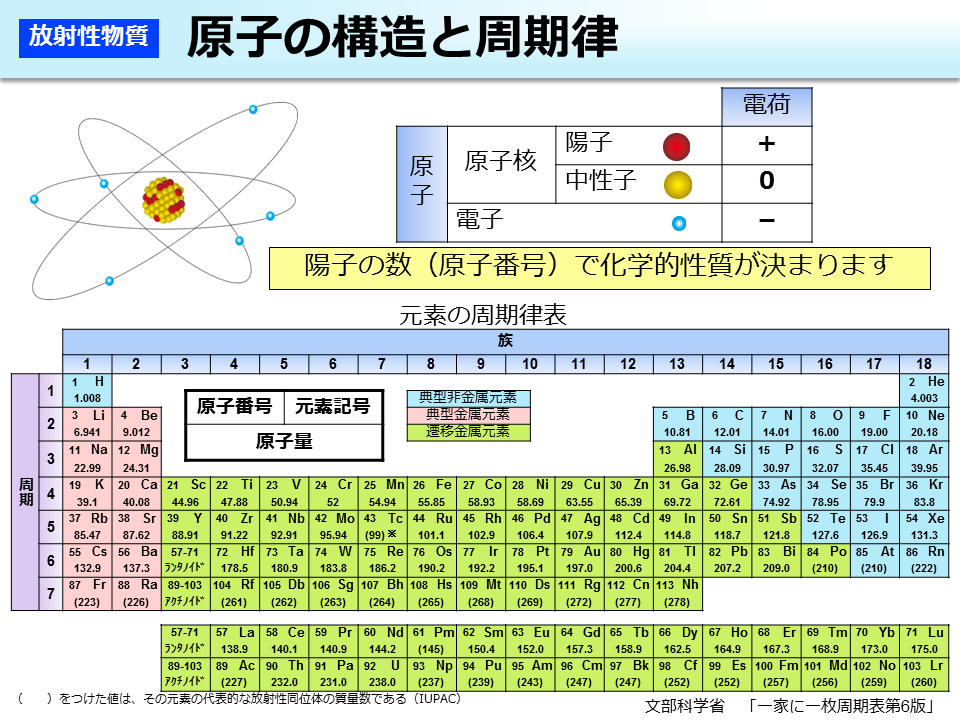
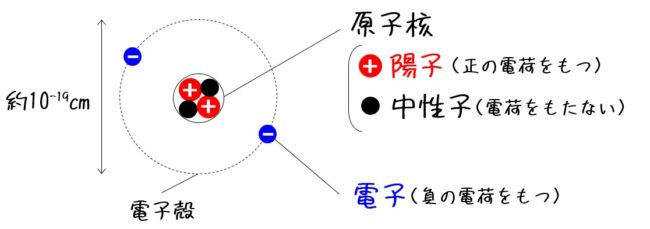
原子の構造と周期律 原子は原子核とその周りを回る電子から構成されています。 原子核はプラスの電荷を持つ陽子と電荷を持たない中性子で構成されており、原子の化学的性質(元素の種類)は陽子の数(原子番号)で決まります。 例えば炭素は陽子が6 左下の数字は原子番号です。 左上の数字は質量数です。 原子番号はその元素によって固有の値なので読む必要はありません。 質量数は中性子数で変化するので読む必要があります。 (最も安定な同位体は読まないことが多い) 原子番号(陽子の数)は、元素の記号の左下にある下付き文字です。 質量数 (陽子と中性子の合計)は、元素記号の左上にある上付き文字です。 たとえば、 水素元素の核記号 は次のとおりです。 1 1 H、 2 1 H、 3 1 H 上付き文字と下付き文字が互いに並ん
原子番号が小さなところでは、陽子の数と中性子の数は確かにほぼ同じですが、原子番号が大きくなるにつれて、中性子が多めになってきます。そのことは、質量数 = 原子番号 × 2 の直線を引いてみるとよくわかります。右に行けば行くほど、その直線から原子番号6 炭素・Cには、質量数の異なる、 12 C、 13 C、 14 Cなどの同位体がある。 このうち、 「放射性同位体」なのは 14 C (炭素14)。 「10の9乗」を書きたい →109と書く. →9の部分だけ選択して(反転させて),右クリックを押す. →「フォント」を押すと,「上付き」や「下付き」がでてくるので,ここでは「上付き」を押す →そうすると10の9乗の9が10の肩にのります.




質量数とは 求め方 みんなが知りたい2つの疑問を解消 高校生向け受験応援メディア 受験のミカタ



Www Zkai Co Jp Wp Content Uploads Sites 15 19 09 Qcs5a1z1a2 1 Pdf
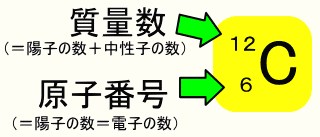
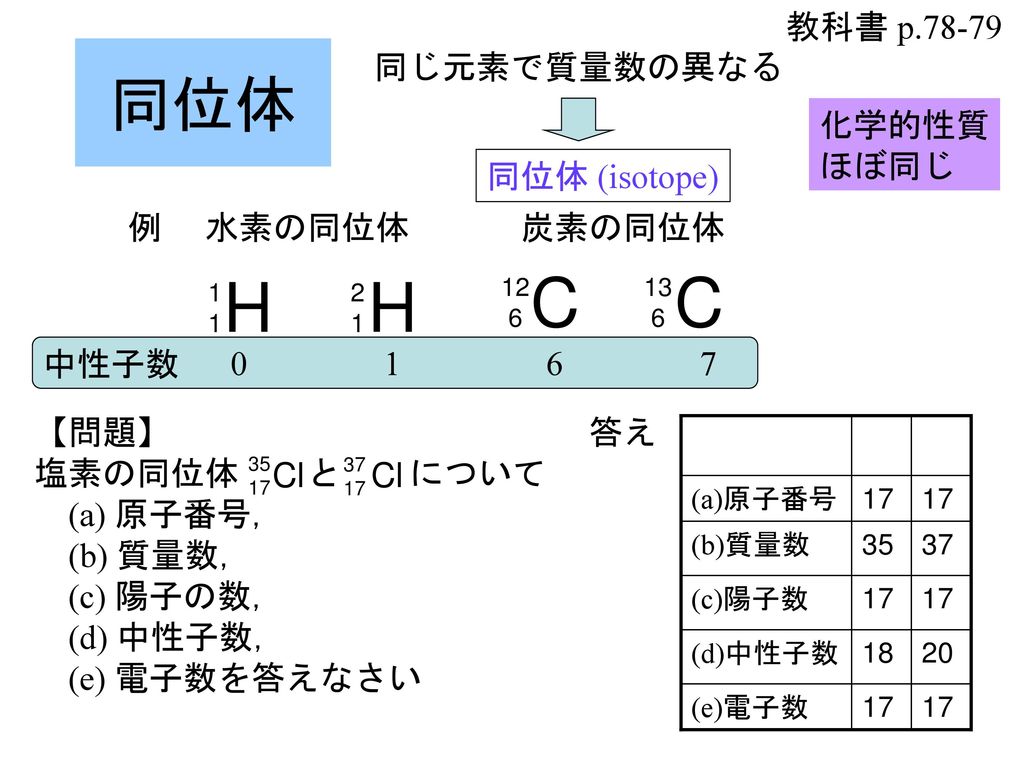
ある特定の原子を表わすときには、元素記号、原子番号、質量数の3つ を用いて下の図のように書きます。原子番号は省略されることもあります。 例えば14nと書いて"窒素14"と読みます。 原子番号と質量数 11 窒素の元素記号 質量数 (核子の数) 原子番号 (陽子の数) 14n 7 自然界には水素からウランま で約90種類もの元素がある表2 電子,陽子,中性子のデータ. 記号 電気量 質量kg 質量u 質量比 電子 e electron e 10 31 kg 1/13 u 1 陽子 p proton e 10 27 kg u 1615 中性子 n neutron 0 10 27 kg u 1868 同位体 原子番号が同じでも,中性子数が違う原子が存在する.それらを同位体そこで、「原子の質量」≒「原子核の質量」と考えるわけです。 このように、 「質量数」=「原子核の質量」=「陽子の数+中性子の数」 を覚えておきましょう。



Q Tbn And9gcrlao1ib55oqv4lnss00rjmw0yuu6lvtspqzwgl19i3p6wnb J8 Usqp Cau




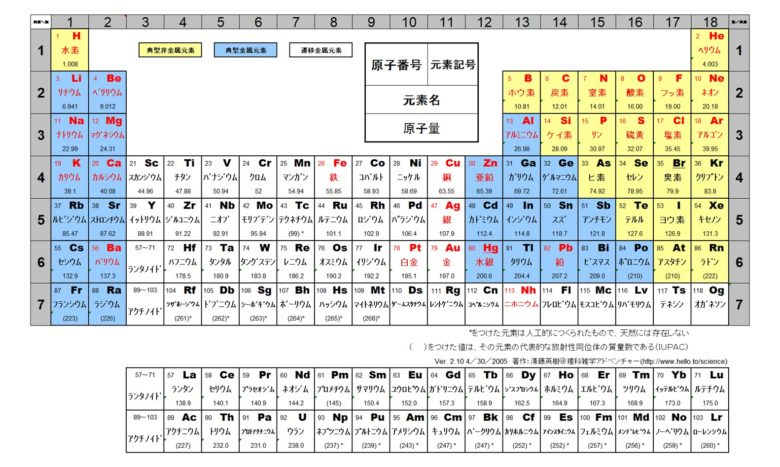
株式会社 マテリアルハウス 金属あれこれ 周期表
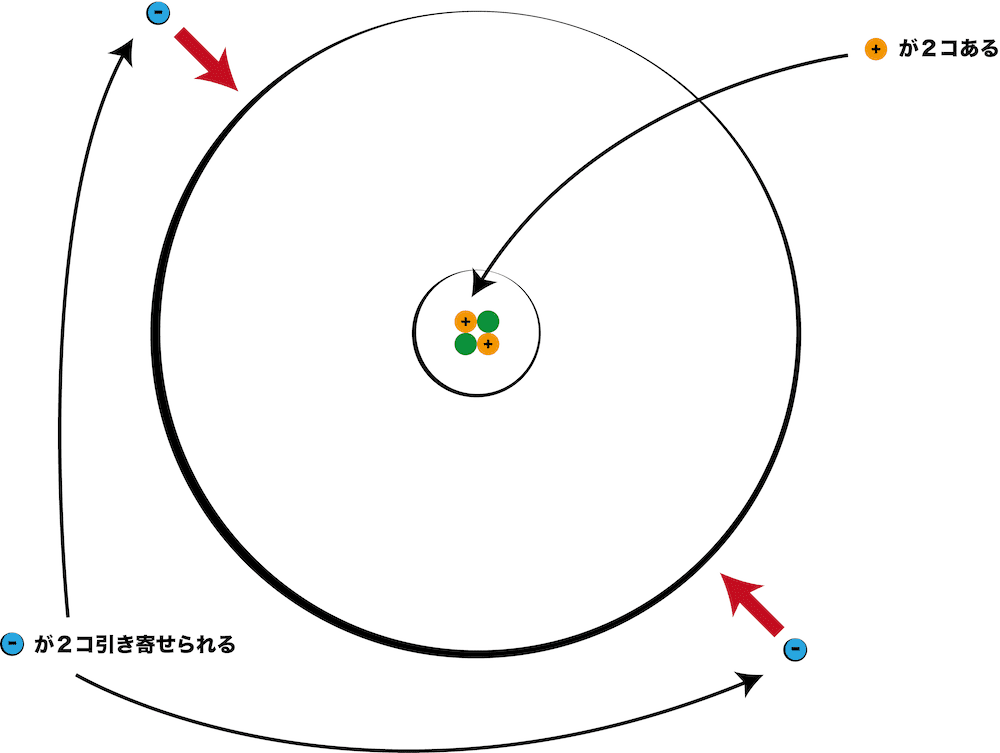
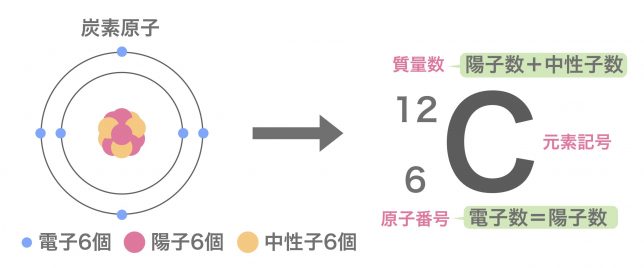
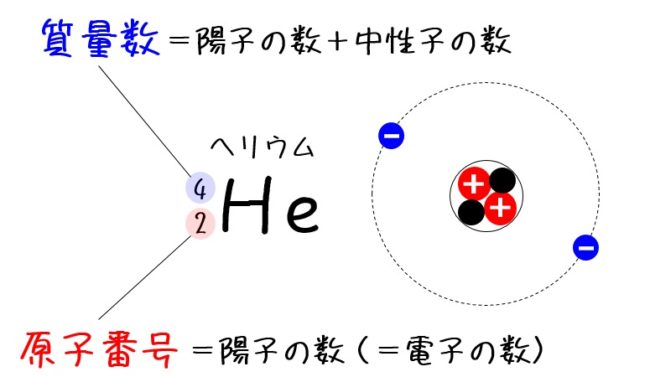
原子番号は陽子の数をもとにつけられていて、 Heは陽子を2個もつので原子番号は2番です。原子の重さを表すと きには、電子は陽子に比べてはるかに軽いので電子の数は無視して、 陽子と中性子を足した数で表します。これを「質量数」といいます。 質量数原子番号 0 二酸化炭素の電子式の問題についてです。 2枚目の青丸のところが回答と書き方が違うのですが、私の答えでも丸にして大丈夫でしょうか?元素記号と質量数の間にハイフンを使用しています。 一方、元素をカタカナ表記にしているときは セシウム137 と 元素名と質量数の間にハイフンを入れておりません。
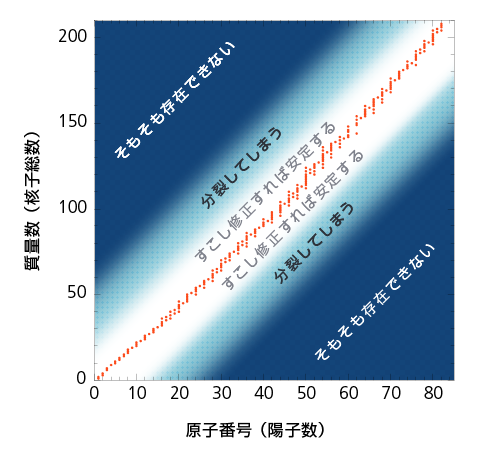



第2章 どうやって放射線が出てくるのかについて考えよう 放射線について考えよう




図解版 原子 分子 元素の違いと原子の構造を解説 陽子 中性子 質量数 原子番号 サイエンスストック 高校化学をアニメーションで理解する
原子核や質量数、同位体の語呂合わせ 陽子数、中性子数、原子番号など 18H30大学入学共通テスト試行調査第2回第1問C 問5 共通テスト 元素・結晶 覚え方・暗記法に悩む 高校生・ 既卒 生・大学受験生向けの、 高校化学に関する語呂合わせブログです前ページに表で示したように、原子を構成する3つのパーツの質量比は次のようになっている。 陽子:中性子:電子 1:1: 陽 子 : 中 性 子 : 電 子 = 1 : 1 : 1 1840 そして、 原子番号と同数のZ個の電子 が原子核の周りをまわっています。 さらに、核子である陽子と中性子の数を合わせて 質量数 と言い、 A (原子質量数を表すドイツ語Atommassenzahlに由来)で表します。




質量数とは 求め方 みんなが知りたい2つの疑問を解消 高校生向け受験応援メディア 受験のミカタ
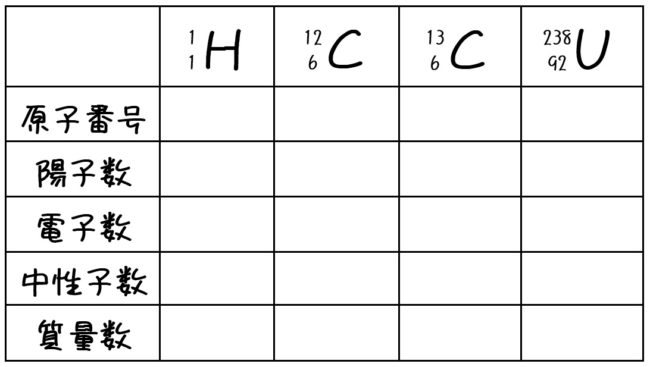



化学基礎 原子の構造 原子番号 質量数 Tekibo
35 × 76 100 37 × 24 100 ≒ 355 となります。 計算は、以下のように工夫して行うと楽に解けます。 35 × 76 100 37 × 24 100 = 35 × 76 100 ( 35 2) × 24 100 = 35 × 76 100 35 × 24 100 2 × 24 100 = 35 × 76 24 100 2 × 24 100 = 35 231 原子核の質量 43 MassExcess 同じ質量数A をもつ原子核におけるエネルギーの関係を考える際には,質量そのものや結 合エネルギーよりも,次の式で定義されるmassexcessのほうが便利なことが多い. ∆M(A,Z)=M(A,Z)−Au (39) 結合エネルギーを用いてmassexcessを表すと, ∆M(A,Z)=Zm概要 原子核の中の陽子の数は原子番号 z と呼ばれ、元素の化学的性質を決定する。 また原子核の中の核子(陽子、中性子の総称)の総数(中性子の数+陽子の数)は質量数 a と呼ばれ、これは個々の原子の原子量に最も近い整数となる。 なお、z と a がわかれば中性子数 n は n = a z で求める
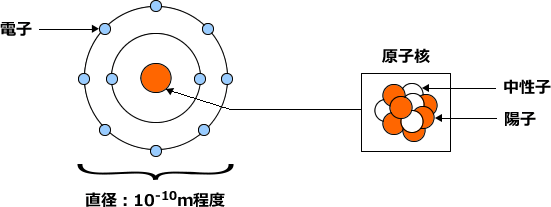



化学講座 第1回 原子のつくり その 1 私立 国公立大学医学部に入ろう ドットコム




元素周期表 見やすい表で覚え方と元素を解説 ゴロ合わせも 高校生向け受験応援メディア 受験のミカタ
質量数とは?求め方と原子番号との関係をまとめてみた 化学基礎 12 同位体とは何か、存在比の求め方をまとめてみた 化学基礎 混合溶液の扱い、濃度差が大きい溶液を混合するときの留意点! 化学基礎 LINE Pocket 図解高校化学基礎より、原子の構造、分子との関係性、原子と元素の違い、陽子・中性子・電子・質量数・原子番号の関係性と違い、原子核とは何かなど、具体的に図を示しながら丁寧に解説します。 僕は10年以上にわたりプロとして個別原子の質量数 原子の質量数は、陽子の数+中性子の数です。 \(\color{red}{(質量数)=(陽子の数)+(中性子の数)}\) 陽子の数は原子番号と一致します。 例えば、炭素は原子番号 6 で陽子を6個持っていて、中性子の数が6の場合質量数は 12 となります。



質量 数 と は 質量数とは Docstest Mcna Net




原子の構造と原子番号と電子数および質量数
(たとえば、水素hの右上に、質量数2、左下に原子番号1をつける場合のことです) Word Open Office Writer で原子番号、原子量の表示された元素記号を書きたいのですが、原子量を上、原子番号を下にしたとき、それぞれの数字は上下に並びません。 α壊変 α粒子を放出する壊変様式 質量数は4、原子番号は2減少する。 五十鈴「例外はあるけど、一般に質量数0以上の大きい原子核で起こるわ。例えば」 七海「ラジウム226がα崩壊してラドン222に水素の元素記号は、Hで表します。 Hの左下の数字は、原子番号を表しています。 原子番号は、原子核の陽子の数と同じです。 また、Hの左上の数字は、原子核の質量数を表しています。 質量数は、陽子と中性子の数の合計と同じです。 原子核の質量数の違いに応じて、普通の水素、重水素、三重水素は、それぞれ水素1、水素2、水素3と表すことができます




同位体とは 同素体との違い 覚え方も早稲田生が紹介 高校生向け受験応援メディア 受験のミカタ




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット




同位体と同素体 存在比 理系ラボ




物質を構成する粒子



1



Www Zkai Co Jp Wp Content Uploads Sites 15 19 09 Qcs5a1z1a2 Pdf



中2化学 原子と分子 中学理科 ポイントまとめと整理




Images Of 質量数 Japaneseclass Jp



Http Theochem Chem Okayama U Ac Jp Vitroid E6 95 99 E9 8a E7 E7 90 86 E5 8c 96 E5 Ad A612 12 10 12note2 Pdf
/atomic-structure-artwork-530398384-5773248a3df78cb62c044167.jpg)



同位体原子の陽子と中性子の数を見つける方法



原子の構造 陽子 中性子 電子 原子核 質量数 原子番号の数と関係 化学のグルメ



Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 07 Pdf




原子の構造と原子番号と電子数および質量数



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Mass Number



化学基礎 原子の構造 原子番号 質量数 Tekibo




原子核に含まれる陽子の数は 元素ごとに決まっていて 陽子の数と電子の数は等しいと習っ Clear
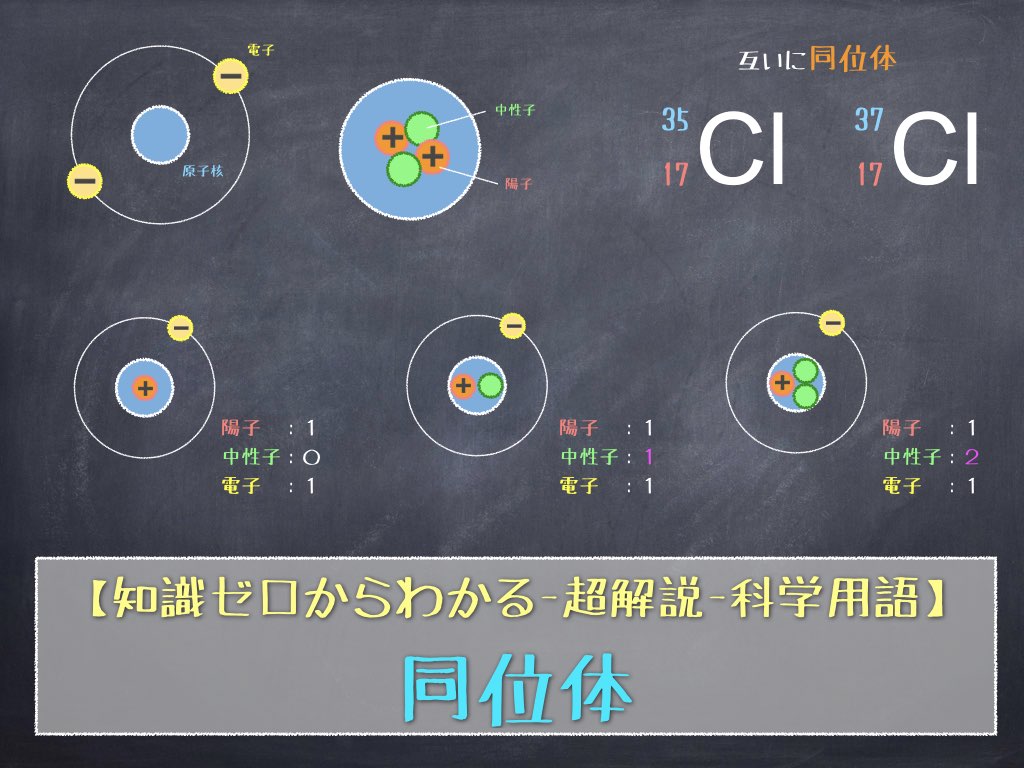



知識ゼロからわかる 超解説 科学用語 同位体 理化学ラボーブログ



原子の表し方で 原子記号の左上に付いている数字は 質量数 陽子 Yahoo 知恵袋




京大生が書いた高校化学基礎編 有効数字の見方 や 化学式の書き方 からはじめる I O Books Amazon Com Books




元素記号 Wikiwand



原子の構造 陽子 中性子 電子 原子核 質量数 原子番号の数と関係 化学のグルメ



Http Theochem Chem Okayama U Ac Jp Vitroid E6 95 99 E9 8a E7 E7 90 86 E5 8c 96 E5 Ad A612 12 10 12note2 Pdf




粒子の相対質量と物質量



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Relative Mass



急ぎです ワードで 元素記号の左側に原子番号と質量数をバランスよ Yahoo 知恵袋
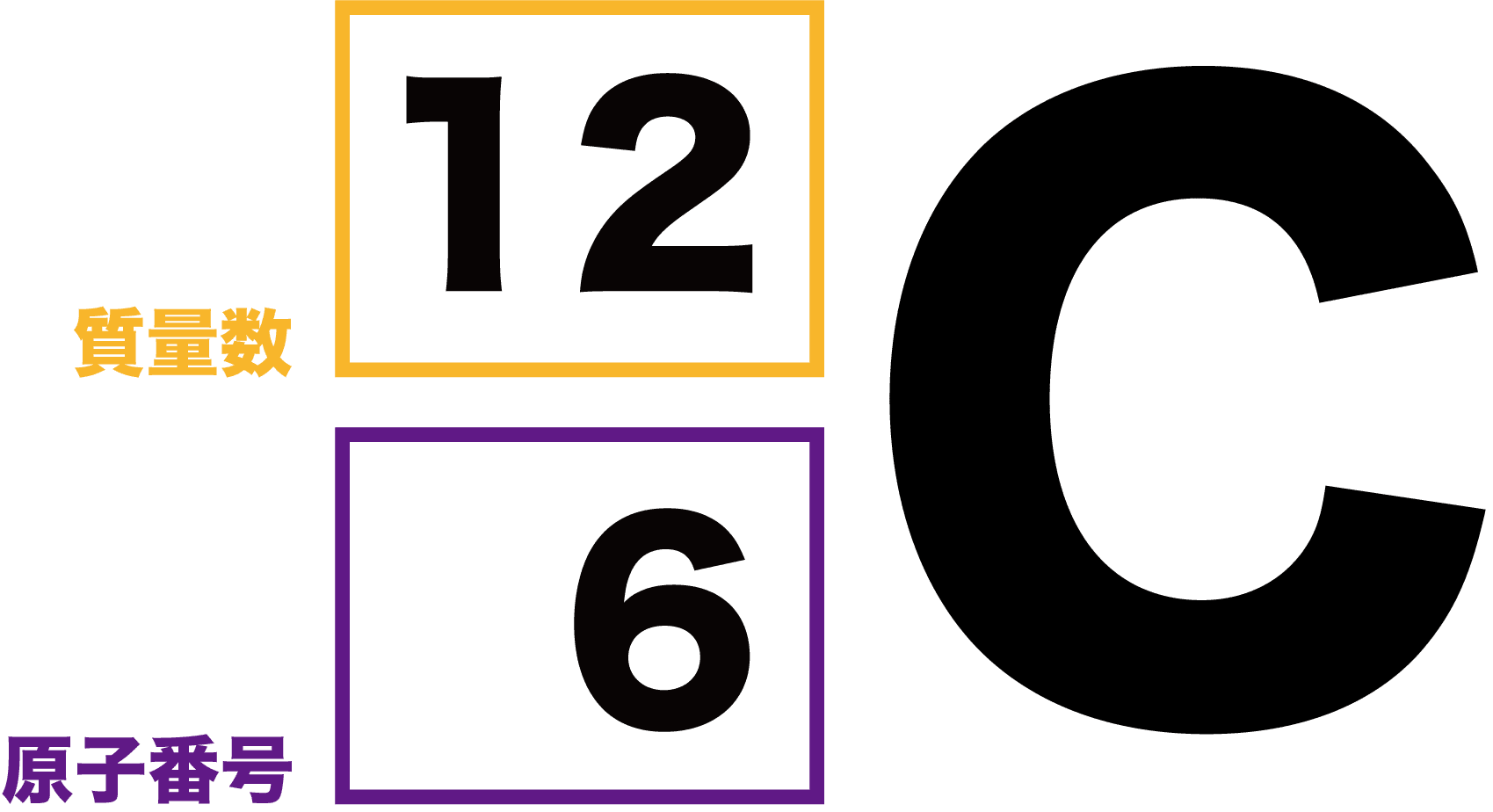



原子の構造 陽子 中性子 電子 原子核 質量数 原子番号の数と関係 化学のグルメ




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット




高校化学 原子 質量数の表現方法 オンライン無料塾 ターンナップ Youtube



基礎化学




化学基礎 原子の構造 原子番号 質量数 Tekibo
/oxygen-chemical-element-186450996-5810f05f3df78c2c7313f35a.jpg)



このサンプル問題で同位体と核記号を確認する



世界は3種類の粒からできている 原子の構造について 高校化学をスキマ時間でわかりやすく



環境省 原子の構造と周期律




原子の構造 原子番号と質量数の関係 Dr あゆみの物理教室



教養の化学 第5週 13年10月21日 担当 杉本昭子 Ppt Download




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット



Www Nhk Or Jp Kokokoza Tv Kagakukiso Archive 21kagakukiso 07 Pdf




中性子 電子 質量数の数はそれぞれどうやって求めるんですか 陽子の数 原子番号なのは Clear



化学基礎 原子の構造 原子番号 質量数 Tekibo



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Atomic Structure



金箔にa線を照射して 通過するa線の軌跡を調べた ラザフォードの実験 ほとんどのa線は通過 小さい確率ながら跳ね返ったり Ppt Download



Http Www Kyoiku Shuppan Co Jp Textbook Chuu Rika Files Web Syukihyo Pdf



3



化学基礎 原子の構造 原子番号 質量数 Tekibo



原子番号2 質量数4のヘリウム原子を表記した上で 原子の表記 Yahoo 知恵袋



みかみの参考書ブログ
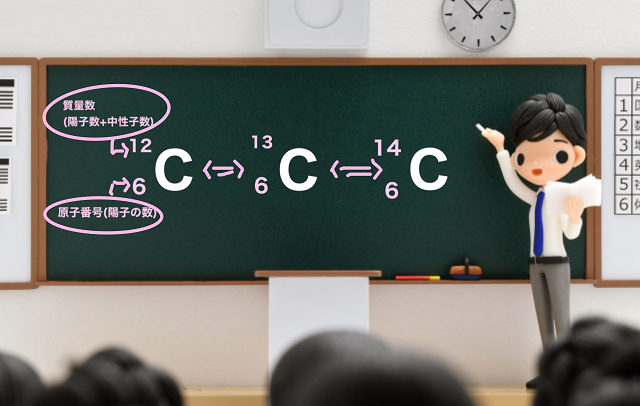



同位体とは 炭素を例に分かりやすく解説 オキシクリーンの使い方 注意点を知るために化学 物理 生物を学ぼう




元素記号 Wikipedia




高認化学の過去問 21年第2回4 5 6




質量数とは 求め方 みんなが知りたい2つの疑問を解消 高校生向け受験応援メディア 受験のミカタ



化学反応式の書き方



1




補足説明 2 元素記号を用いた原子核の表し方 公益財団法人 日本分析センター Japan Chemical Analysis Center



Numb016




元素周期表 見やすい表で覚え方と元素を解説 ゴロ合わせも 高校生向け受験応援メディア 受験のミカタ




原子核物理の基礎 2 原子核の壊変 03 06 03 02 Atomica




3分でわかる 同素体と同位体の違いと例を画像と図で解説 語呂合わせ付き サイエンスストック 高校化学をアニメーションで理解する




9 10 11 12はどうやって求めればいいのですか Clear




原子の構造 原子番号と質量数の関係 Dr あゆみの物理教室




これは 暗記するしかないですか 質量数なのど 暗記してないと書けないですよね Clear




原子核に含まれる陽子の数は 元素ごとに決まっていて 陽子の数と電子の数は等しいと習っ Clear




原子 分子 元素の違いと陽子 中性子 質量数 原子番号 Vicolla Magazine




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット




高校化学基礎 原子番号と質量数 練習編 映像授業のtry It トライイット



1 2 原子の構造 おのれー Note



2




原子量と質量数って同じもの この2つの違いってあるの 化学受験テクニック塾



2



34 Aとbはある元素の同位体である Aの原子番号はzで Aとbの質量数の和 Yahoo 知恵袋




この 1 の質量数はなぜ17になるのですか Clear




元素記号 Wikipedia




原子番号ってなに 世界は化学でできている



原子番号 質量数の表記 化学の迷路 ブログ



読むだけでスラスラわかる高校化学基礎 2 原子と原子量




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット




化学基礎 物質の構成16 原子番号と質量数 8分 Youtube




1枚目の は何が入るんですか Clear



金箔にa線を照射して 通過するa線の軌跡を調べた ラザフォードの実験 ほとんどのa線は通過 小さい確率ながら跳ね返ったり Ppt Download




原子の構造 陽子 中性子 電子 原子核 質量数 原子番号の数と関係 化学のグルメ
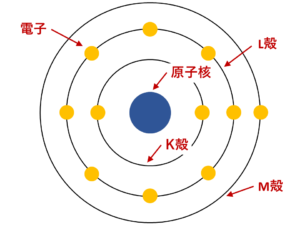



図解 電子配置の書き方の解説と電子配置の一覧 周期表 サイエンスストック 高校化学をアニメーションで理解する



Www Zkai Co Jp Wp Content Uploads Sites 15 19 09 Qcs5a1z1a2 Pdf



Www Meigaku Ac Jp Wp Content Uploads 04 78b5d3e712fb0c0a2cedb65a0384 Pdf




質量 数 と は 質量数とは Docstest Mcna Net
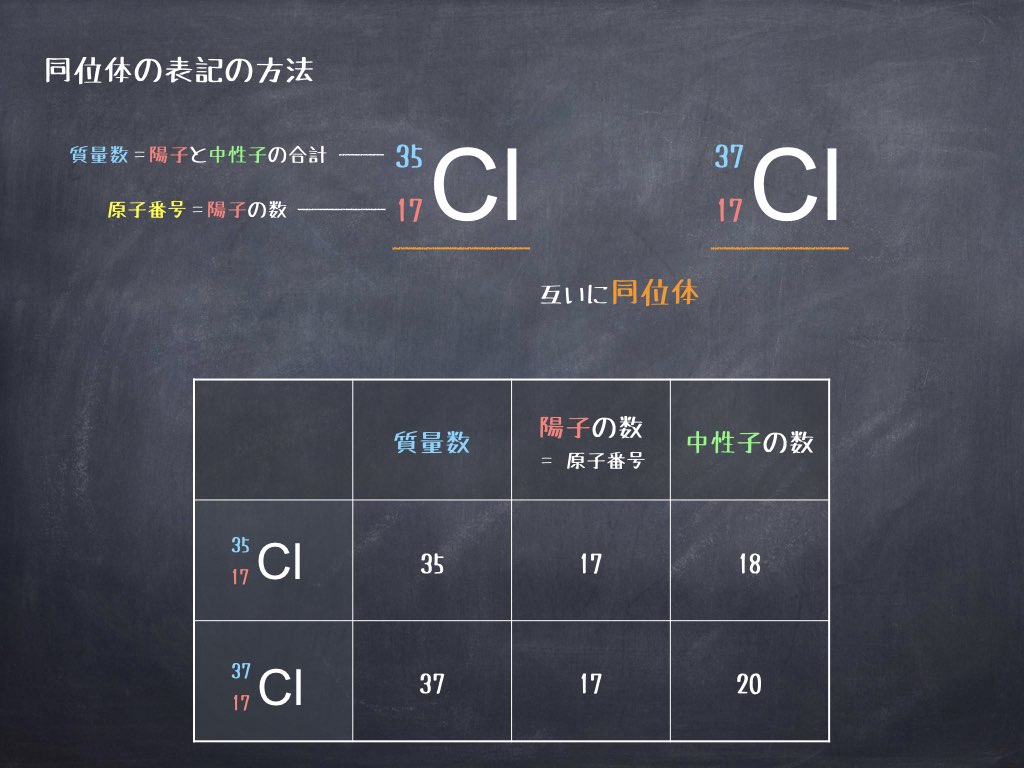



知識ゼロからわかる 超解説 科学用語 同位体 理化学ラボーブログ




高校化学基礎 原子番号と質量数 練習編 映像授業のtry It トライイット




質量数とは 求め方と原子番号との関係をまとめてみた 化学受験テクニック塾



焦らず進もう 第一種放射線取扱主任者試験 物理学第一回 原子の構造




化学基礎 物質の構成16 原子番号と質量数 8分 Youtube



わかりやすい原子と元素の話 原子の成り立ち 原子力まで
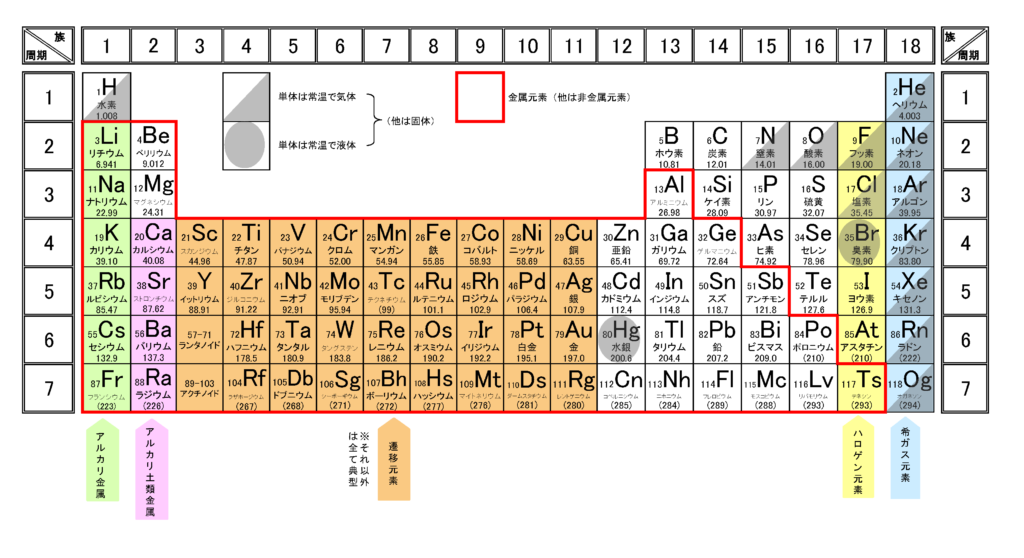



完全版 周期表の語呂合わせの覚え方と族 縦 や周期 横 の見方 サイエンスストック 高校化学をアニメーションで理解する
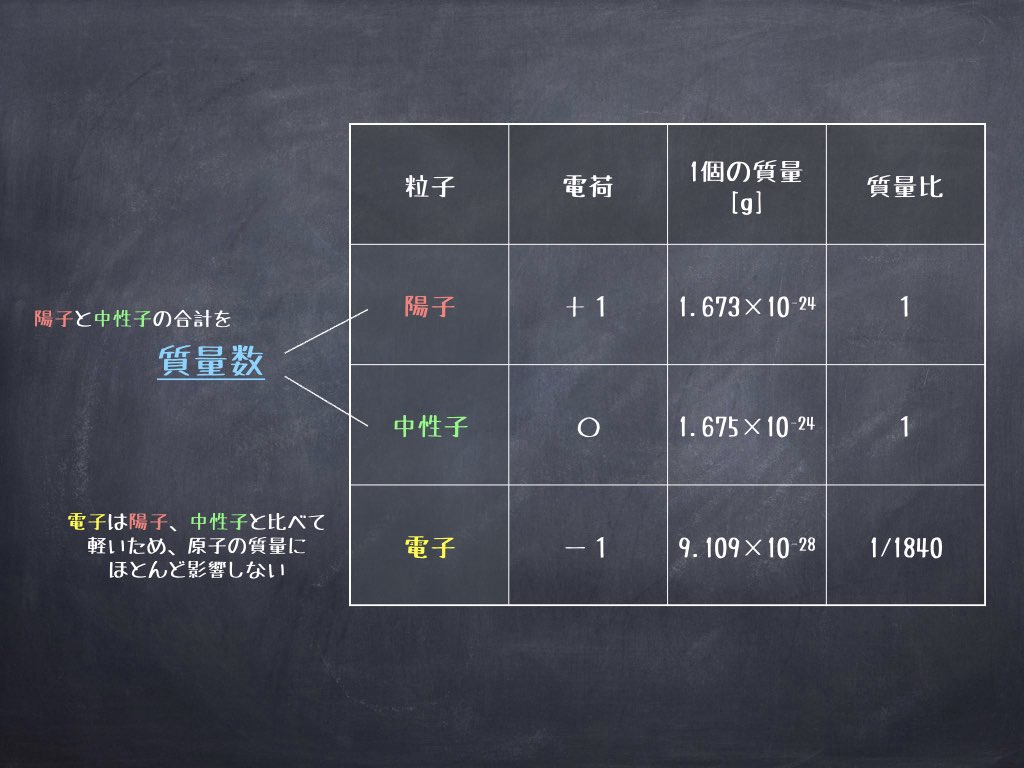



知識ゼロからわかる 超解説 科学用語 同位体 理化学ラボーブログ



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Atomic Weight Mass Number


コメント
コメントを投稿